물속에서도 ‘착’붙는 홍합단백질 비밀 풀었다접착분자들 새로운 시너지 밝혀…홍합 표면접착단백질 디자인 원리 규명
-
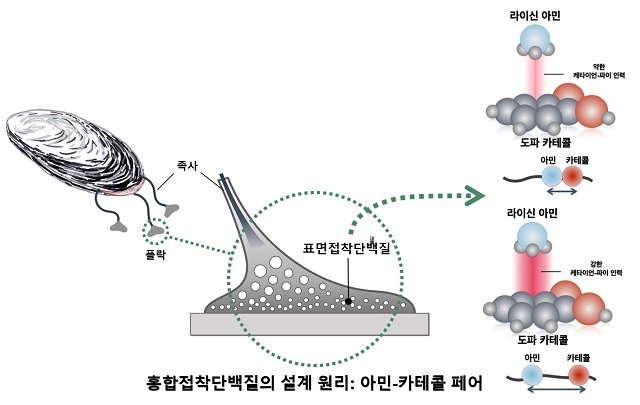
- ▲ 홍합접착단백질의 설계 원리: 아민-카테콜 페이 사진.ⓒ포스텍
POSTECH(포항공과대학교, 총장 김무환) 화학공학과 차형준 교수, 통합과정 신민철씨와 강원대학교 화학과 정영미 교수, 박연주 박사로 이뤄진 공동연구팀은 홍합이 분비하는 표면접착단백질들을 분석해 이를 구성하는 아미노산인 ‘도파(Dopa)’와 ‘라이신(lysine)’의 위치에 따른 상호작용을 확인했다.이들의 적절한 위치에 따라 표면접착력과 응집력에 다른 방식으로 특이적으로 기여할 수 있다는 것을 밝혀 수중접착의 비밀을 푸는데 한발 다가섰다.지금까지 모방했던 홍합접착단백질의 특징은 ‘도파’라고 불리우는 특이 아미노산을 매우 많이 가지고 있다는 것이었다.도파는 자연 아미노산인 타이로신에 수산화기가 하나 더 붙은 아미노산으로, 자연 아미노산이 아닌 도파가 접착단백질의 구성에 많은 부분을 차지한다는 점에 착안해 수중접착 연구가 시작됐다.그러나 연구팀은 홍합의 우수한 수중접착능력이 오로지 한 가지의 분자에 의해 이뤄진다는 점에 의문을 품고, 도파와 비슷한 빈도로 존재하는 ‘라이신’ 아미노산의 개수와 그 위치에 관심을 갖고 관찰을 진행했다.그 결과 도파와 라이신은 약 절반 정도의 확률로 서로 붙어있음을 알아냈다. 한편, 지금까지 알려진 것과는 달리 도파와 라이신이 함께 붙어있는 때, 항상 긍정적인 시너지를 내는 것은 아니라는 것을 밝혀냈다.연구팀은 관찰을 통해 케타이언-파이 인력(cation-π interaction)의 경우는 도리어 부정적인 시너지를 낸다는 점을 확인했다.도파와 라이신이 함께 있을 때, 미시적 수준에서의 물 분자의 밀도의 차이가 발생하게 되고, 도파의 주변의 물분자의 농도가 낮아지게 된다.낮아진 물분자의 농도는 도파의 벤젠고리와 수산화기와의 수소결합력에 차이를 주게되어 케타이언-파이 콤플렉스(cation-π complex)의 구조 안정성을 낮추게 된다.도파와 위치적으로 가까이 위치한 라이신 체인에 위치한 CH2기와 인접한 도파의 카테콜은 분자내 상호작용(intramolecular interaction)을 형성함으로써 분자간 상호작용(intermolecular interaction)의 안정성을 낮춘다는 것을 라만분광학을 통해 확인했다.이번 연구 결과를 통해 홍합의 접착단백질이 어떻게 설계됐는지 확인할 수 있어, 추후 다른 생물들의 접착단백질에 관한 연구에도 활용될 수 있을 것으로 기대된다.차형준 교수는 “수중접착에서 항상 긍정적인 역할을 한다고 알려진 도파와 라이신 두 아미노산 분자의 시너지에 관한 새로운 발견으로 접착소재를 설계하는 방식의 틀을 바꿀 중요한 연구가 될 것”이라며 기대감을 밝혔다.소재과학 분야의 권위지인 ‘케미스트리 오브 머터리얼스(Chemistry of Materials)’에 최근 게재된 이 연구는 과학기술정보통신부와 한국연구재단의 기초연구사업(중견)인 ‘부착성 생물의 수중 접착 기작에의 이해: 표면접착력과 응집력의 균형 조절’ 연구의 일환으로 수행됐다.







