뇌 질환 치료 가능 기대
-
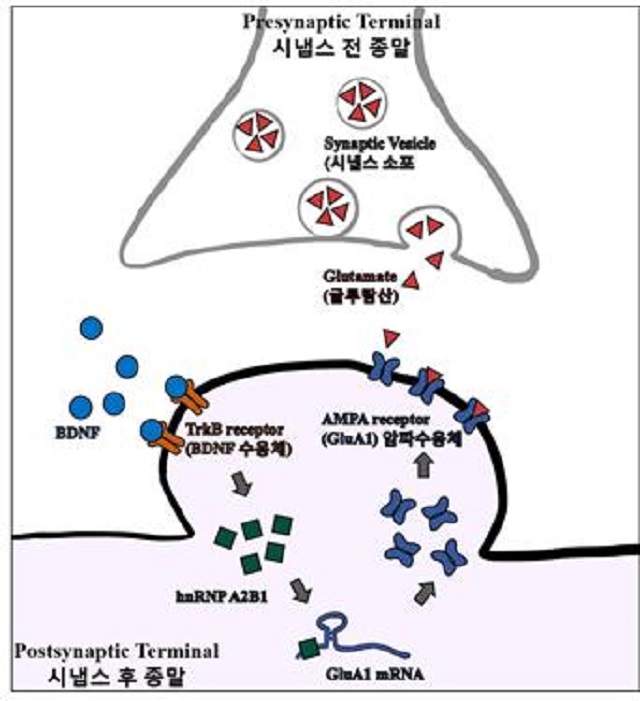
- ▲ BDNF에 의해서 증가한 hnRNP A2B1이 GluA1 mRNA에 결합해 번역(translation) 을 증가시킴으로써 암파 수용체의 합성이 증가했고 따라서 시냅스에서 흥분성 신호(excitatory signaling)의 전달을 효율적으로 담당한다.ⓒ포스텍
POSTECH(포항공과대학교, 총장 김무환) 연구팀은 이 같은 뇌 신경질환이 발생하는 메커니즘을 규명해 뇌 질환 치료의 실마리를 풀었다.POSTECH 융합생명공학부 김경태 교수와 정영섭 박사는 신경세포의 시냅스 기능에 중요한 암파(AMPA) 수용체의 국소적 발현이 BDNF에 의해 조절되는 메커니즘을 규명했다.이 연구 결과는 세계적 권위의 국제학술지 '사이언스 어드밴시스(Science Advances)' 11월호에 게재됐다.암파 수용체는 글루탐산이 작용하는 이온통로 수용체로서 흥분성 신경신호를 담당하고 있다.이 수용체는 신경세포의 수상돌기 가시구조에 위치해 시냅스에서 분비되는 글루탐산을 인식해 신호를 전달한다.시냅스 가소성을 위해 암파 수용체의 합성은 신경자극의 강도와 기간, 빈도에 따라 효율적이며 신속하게 국소적으로 일어나야 한다.이 암파수용체 mRNA가 시냅스에 존재한다는 사실은 이미 알려져 있었지만 지금까지 이 mRNA가 어떻게 수용체 단백질로 합성되는지에 대한 메커니즘은 자세히 알려지지 않았다.연구팀은 암파 수용체 mRNA의 앞부분에 IRES(Internal Ribosome Entry Site) 활성이 있는 부위가 있으며 일반적인 방식과는 달리, 이 부위에 RNA 결합 단백질인 hnRNP A2/B1이라는 단백질이 결합하면 단백질 번역이 증가한다는 사실을 밝혔다.핵에서 전사돼 만들어진 암파 수용체 mRNA는 수상돌기로 이동해 대기하고 있다가 신경자극이 오면 이에 반응해 신속하게 수용체 단백질로 번역되는 것을 확인한 것이다.BDNF가 신경세포를 자극하면 hnRNP A2/B1의 양이 많아져 암파 수용체 단백질의 합성을 촉진한다. 이렇게 만들어진 암파 수용체 단백질은 시냅스에 포진해 신경신호전달을 효율적으로 수행한다.김경태 교수는 “뇌 발달장애나 뇌 신경세포의 퇴행을 막는 핵심적인 메커니즘을 밝힌 연구”라며 “향후 자폐증이나 치매와 같은 퇴행성 뇌질환의 치료에 중요한 단서를 제공할 것으로 기대한다”고 말했다.한편, 이 연구는 한국연구재단 뇌과학원천기술과제, 중견연구자지원사업, 농촌진흥청의 차세대바이오그린21과제의 지원으로 수행됐다.







